Pokud se jedná o biologickou léčbu, zdravotní pojišťovny dlouhodobě potvrzují dvě skutečnosti: celkové náklady na ni dál rostou, příchod biosimilárních přípravků ale umožnil, že se k ní dostane více lidí. Během let 2008–2018 se díky biosimilars ušetřilo 1,5 miliardy korun. Záměnu originálního biologického léku za jeho levnější, biosimilární variantu musí pacient vždy odsouhlasit. Zásadní význam proto má edukace nemocného a umění správně mu tento krok vysvětlit. Nejen o tom byl letošní ročník odborného semináře Biosimilars a tisková konference, která mu těsně předcházela.
Výsledky switchů zřejmě ovlivňují spíše faktory na straně pacientů než efekt léku
Je již dobře známo, že biologická léčba přinesla významný pokrok v terapii řady onkologických či autoimunitních diagnóz. Mezi obory, kde to platí, patří revmatologie. Ředitel Revmatologického ústavu Praha prof. MUDr. Karel Pavelka, DrSc., zdůraznil další známý fakt: existuje dostatek důkazů o tom, že biosimilární léky schválené ve vysoce regulované oblasti (tedy například Evropskou lékovou agenturou, americkým Úřadem pro potraviny a léčiva či japonskou lékovou agenturou) se neliší od originálních biologických léků. Stejně tak se podle jeho slov dnes má za prokázané, že převedení (z angl. switch) pacienta z originálního léku na biosimilární je bezpečné. Prof. Pavelka v této souvislosti připomněl významnou a často citovanou studii Nor Switch, která předložila důkazy o bezpečnosti switche z referenčního na biosimilární lék hned u šesti autoimunitních onemocnění, i rovněž často zmiňované studie revmatologické (extenze studie PLANETRA, dále také viz Emery P. et al., Ann Rheum Dis 2017; Tony H.-P. et al., Arthritis Care Res 2019). O účinnosti a bezpečnosti switche z referenčního na biosimilární přípravek hovoří i údaje z českého registru ATTRA (viz Data z registru ATTRA).
Naopak dosud stále chybí dostatek důkazů o obdobné bezpečnosti switche z jednoho biosimilárního léku na jiný biosimilární lék a není prokázána bezpečnost vícečetných switchů.
Velmi zajímavé výsledky přinesla dánská studie DANBIO, která obnášela mandatorní převedení z originálního na biosimilární etanercept. Prof. Pavelka shrnul klíčové poznatky. Switchovalo 1621 z 2061 (79 %) pacientů. Jinými slovy, přes národní povinná doporučení cca 20 % dánských pacientů bylo dále léčeno originálním etanerceptem, neswitchovalo. „Základní charakteristiky pacientů, kteří switchovali a neswitchovali, se lišily. Adjustovaná retence na léku byla nižší u switchujících pacientů než u historické kohorty, ale vyšší než u neswitchující kohorty. Ukončení léčby bylo častější u pacientů, kteří nebyli v remisi,“ vyložil prof. Pavelka. Dodal, že „výsledky switchování v běžné klinické praxi se zdají být více ovlivněny faktory na straně pacientů než specifickým efektem léků“.
Pro použití biosimilárních léků při léčbě revmatických onemocnění existuje aktuální konsenzuální doporučení (Kay J., et al. Ann Rheum Dis 2018), které prof. Pavelka shrnul (viz Konsenzuální doporučení pro použití biosimilárních léků v revmatologiiv pokračování článku na webu – www.terapie.digitalnebo QR kód). Jak uvedl, na vzniku doporučení se podílelo 25 expertů (osm z evropských států, dále z USA a Japonska) a předcházela mu analýza 416 publikací, zařazeno bylo 29 prací a 20 abstrakt.
Jak eliminovat nocebo efekt? Vyhradit si na pacienta dostatek času
Prof. Pavelka konstatoval, že switch by měl provádět lékař-specialista po diskusi s pacientem v ordinaci. Pokud je totiž pacientům lék vyměněn dříve, než změnu správně pochopení, může dojít k takzvanému nocebo efektu, tedy k opaku efektu placeba. Nocebo efekt se projevuje horším účinkem léku v důsledku přesvědčení nemocného o špatných vlastnostech užívaného přípravku. Jinými slovy, pokud je pacient přesvědčen, že lék je levnější proto, že je méně účinný, může na nějhůře působit.
Skutečnost, že komunikační strategie ovlivňují účinnost léčby a adherenci pro switchování, v revmatologii prokázaly i provedené studie BIO-SWITCH (převod z infliximabu na CT-P13) a BIO-SPAN (převod z etanerceptu na SB4). Jako důsledky nocebo efektu se mohou projevit nonadherence pacienta, ztráta medikace, zvýšené náklady na korekci suboptimálního efektu, zhoršené symptomy a psychologický stres, potřeba dalších léků, zvýšená frekvence switchů, ale i ztráta důvěry pacienta vůči lékaři. „Vliv dat z těchto observačních studií ovlivňuje interpretaci výsledků randomizovaných studií,“ uvedl prof. Pavelka.
„Velmi důležitým faktorem je vyhradit si na pacienta dostatek času, aby bylo možné podat přesné a srozumitelné informace,“ apeloval prof. Pavelka.
Interakce lékař, sestra a pacient při podávání biosimilárních léků podle jeho slov zásadním způsobem ovlivňují výsledky terapie. „Zahrnutí sester do vzdělávání pacienta a jeho léčby může optimalizovat standard léčby,“ upozornil prof. Pavelka. „Sestry se často účastní managementu chronických onemocnění, mají dobrý, empatický vztah a zlepšují interakcipacient –lékař, mají také více času na edukaci pacientů než lékař,“ uvedl. Připojil dáledůležité faktory správné komunikace s pacientem – základ tvoří dobrá znalost problematiky biosimilárních léků na straně lékaře i sestry, dobrá znalost způsobů komunikace s pacienty, vyhrazení si potřebného času. Svou roli hraje i forma edukace (ústní, písemná, elektronická),informace by měly přesné, srozumitelné, krátké a pozitivní,vhodnéje pokud možno se vyhnout zmínkám o negativních faktorech. Jako příklad pozitivní versus negativní informace použil sdělení „šance na přežití u rakoviny je dvě ku třem“ versus „šance na úmrtí u rakoviny je jedna ku třem“.
Hlas pacientské organizace k biosimilars: mírně konzervativní a požadující další data
A jak se na biosimilars dívají pacienti? Prof. Pavelka to přiblížil citací následujících bodů ze stanoviska evropské pacientské organizace PARE (People with Arthritis/Rheumatism in Europe):
- Aby se potvrdila bezpečnost biosimilars, pacienti si přejí více studií po schválení EMA, než setyto přípravky dostanou na trh.
- V současnosti PARE zastává konzervativní postoj a je toho názoru, že jsou nezbytné další randomizované, dvojitě zaslepené, kontrolované studie s dostatečným počtem účastníků, aby bylo možné zdůvodnit extrapolační postup, zejména při extrapolaci z nerevmatické na revmatickou indikaci.
- Indikace, které nebyly testovány v souvislosti se schvalováním biosimilárního přípravku, ale byly povoleny extrapolací, by měly být uvedeny v příbalové informaci.
- Žádný pacient by neměl být převeden z původního přípravku na biosimilární z důvodu hospodárnosti proti své vůli. Switch by měl být vždy založen na společném rozhodnutí pacienta a lékaře.
- Pacient musí souhlasit jak s biosimilárním lékem, tak s farmaceutickou dávkovou formou.
- Preskripce v extrapolovaných indikacích vyžaduje souhlas pacienta a pečlivé sledování lékařem.
- Pokud neexistují žádné studie, nedoporučuje se switch mezi různými biosimilárními přípravky.
- Vzhledem k obavám z imunogenicity biologických přípravků by neměly být prováděny vícečetné, z medicínského hlediska zbytečné změny léčby, pokud nejsou k dispozici údaje ze studie.
- Originální léky a biosimilars by neměly být vzájemně zaměnitelné v lékárnách.
Placebo a jeho efekt – věčné etické téma
Účinek placeba funguje přinejmenším v tom smyslu, že zlepšuje adherenci pacienta k léčbě. Jak uvedl ředitel Národního ústavu duševního zdraví prof. MUDr. Cyril Höschl, DrSc., na přijetí léku pacientem mívá vliv i barva tablety nebo vzhled krabičky. „Někdy může neúčinnost léku či výskyt nežádoucích účinků způsobit i četba příbalového letáku,“ dodal. Jak shrnul, placebo je stále nutné z metodologického hlediska, i když je těžko akceptovatelné z hlediska etického (když se nesmí používat k léčbě, je etické podávat ho ve studiích?). Připomněl, že v řadě studií je placebo nahraditelné například aktivním komparátorem. „Podle Helsinské deklarace lze pacienta léčit pouze osvědčeným účinným lékem, eventuálně nový lék zkoušet jen proti němu. Proto se povoluje placebo tam, kde není dosud žádná prokázaná léčba nebo kde je to z metodologického hlediska nezbytné, neboť v opačném případě by nebylo možné uvést žádný nový lék, protože i ten se může ukázat být ,placebem‘, tedy o nic etičtejší než placebo,“ vysvětlil. „Zkoušení různých dávek nového léčiva proti sobě problém placeba neřeší –nízká dávka rovněž není o nic etičtější než placebo.“
V krátkém výletu do historie prof. Höschl mimo jiné připomněl, že první medicínské využití placeba se datuje do 18. století. Na konci 18. století bylo považováno za samozřejmost a v roce 1811 bylo definováno (někdy hanlivě) jako „každá medicína, která pacienta spíš utěší, než mu prospěje“ (Shapiro,1968),„ale vždy s efektem!“ (Kaptchuk,1998).
Eventuální příznivý vliv na zdravotní stav pacienta může být do určité míry dán složením placeba. Prof. Höschl připomněl, že placebo často obsahuje rostlinné oleje (olivový, kukuřičný) a laktózu. „Tyto oleje mohou antioxidačními a protizánětlivými účinky polynenasycených mastných kyselin farmakologicky zlepšit profil lipidů a srdeční potíže. Laktóza může u nemocných s neoplasmaty vinou svých averzivních účinků zlepšit účinnost testovaného léku a podobně,“ uvedl.
Připojil také příklady prokázaného účinku placeba (viz Placebo efekt v současných studiích).
Důvodů placebo efektu může být více. Prof. Höschl mezi nimi uvedl spontánní remisi, regresi k průměru při počáteční kumulaci extrémů nebo nejednoznačnost příznaků a bias. Zmínil také možná opatření: spontánní remisi lze odhalit zařazením větve bez léčby, regresi k průměru lze předejít správnou randomizací a nejednoznačnost příznaků a bias mohou eliminovat objektivní markery.
Dostupnost léčby se odvíjí i od její ceny
To, zda pacient dostává potřebnou léčbu, se odvíjí od řady okolností. Fyzická existence léku na trhu a adherence pacienta k léčbě jsou stejně důležité jako fakt, zda je léčba dosažitelná nákladově. Vstup biosimilaru na trh obvykle snižuje i cenu originálního přípravku, a to nezanedbatelně – asi o 30 procent. Ze statistik Státního ústavu pro kontrolu léčiv (SÚKL) vyplývá, že pokud by nedocházelo k hloubkovým revizím (při nichž SÚKL znovu posoudí léky v celé skupině a stanoví jejich maximální ceny a úhrady z veřejného zdravotního pojištění), náklady na léky by byly vyšší o 1,5 miliardy korun.
„V podpůrné léčbě v onkologii se díky tomu stala biologická léčba rutinní záležitostí a u revmatoidní artritidy byla výrazně rozšířená dostupnost,“ dodal výkonný ředitel České asociace farmaceutických firem (ČAFF) Martin Mátl.
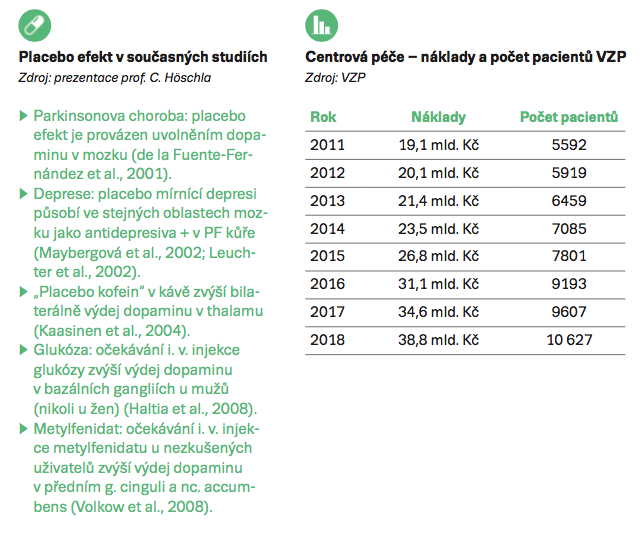
Skutečnost, že biosimilars zpřístupňují léčbu, neboť umožňují za stejný objem peněz léčit více pacientů, potvrdil náměstek ředitele Všeobecné zdravotní pojišťovny (VZP) David Šmehlík. Zatímco v roce 2011 vydala VZP 19,1 miliardy korun na léčbu 5600 pacientů, loni bylo za 38,8 miliardy léčeno přes 10 600 lidí (viz Centrová péče – náklady a počet pacientů VZP). Pouze u metabolických onemocnění celkové náklady VZP mezi roky 2014 a 2017 klesly, náklady u nádorů a rakoviny krve začaly klesat v roce 2016.
Data z registru ATTRA
- Hodnoty parametrů vztahujících se kaktivitě onemocnění se statisticky významně neliší v období tří měsíců před switchem, v době switche a tři měsíce po switchi, a to jak u switchů z originálního na biosimilární infliximab, tak u switchů z originálního na biosimilární etanercept.
- Hodnoty parametrů vztahujících se aktivitě onemocnění jsou v období tří měsíců a šesti měsíců po switchi z originálního na biosimilární etanercept v porovnání s časem switche přibližně stejné. Je patrný mírný pokles SDAI po 6 měsících od switche (p = 0,008).
- V období po switchi je patrný vzrůstající podíl pacientů v remisi.
- Roční setrvání na léčbě biosimilárním infliximabem dosahuje odhadem 91 % pacientů, kteří switchovali z originálního infliximabu, dvou let na léčbě dosáhne odhadem 90 %. Ze 101 pacientů ukončilo léčbu biosimilárním infliximabem 10 pacientů (4 z důvodu ztráty účinku, 2 z důvodu primární neúčinnosti, 2 z důvodu nežádoucí příhody a 2 z jiného důvodu).
- Ročního setrvání na léčbě biosimilárním etanerceptem dosahuje odhadem 86 % pacientů, kteří switchovali z originálního etanerceptu, dvou let na léčbě dosáhne odhadem 82 %. Ze 40 pacientů ukončilo léčbu biosimilárním etanerceptem 6 pacientů (3 z důvodu ztráty účinku, 1 z důvodu nežádoucí příhody a 2 z jiného důvodu).
Zdroj: prezentace prof. K. Pavelky
Konsenzuální doporučení pro použití biosimilárních léků v revmatologii
- ze tří slidů

