Mucormycosis – review of literature and case report
Čerňan M.1, Szotkowski T.1, Machová R.1, Palová M.1, Hamal P.2, Faber E.1
1 Hemato-onkologická klinika LF UP a FN Olomouc
2 Ústav mikrobiologie LF UP a FN Olomouc
Transfuze Hematol Dnes 2021; 27(2): 137–145. doi: 10.48095/cctahd2021137
SOUHRN: Mukormykózy představují heterogenní skupinu vzácných invazivních mykóz s agresivním průběhem a vysokou mortalitou. Nejvíce ohroženou skupinou v evropské populaci jsou nemocní podstupující intenzivní léčbu pro hematologické malignity a alogenní transplantaci krvetvorných buněk. Plicní postižení je nejčastější formou mukormykózy u těchto nemocných. Předkládaná práce shrnuje aktuální literární poznatky z oblasti epidemiologie, diagnostiky a doporučení pro terapii. Přehledový článek je doplněný o kazuistiku – raritní manifestaci kožní formy mukormykózy u nemocného s akutní myeloidní leukemií. Cílem sdělení je podat přehledně aktuální poznatky o této skupině oportunních infekcí s narůstajícím klinickým významem. Jen včasná diagnostika a rychlé zahájení komplexní terapie může vést k vyléčení a záchraně nemocného.
SUMMARY: Mucormycosis represents a heterogenous group of rare invasive fungal infections associated with an aggressive course and high mortality. In Europe, patients undergoing intensive treatment for haematological malignancies and allogeneic hematopoietic stem cell transplantation are at the highest risk of mucormycosis infection. The lungs are the most frequently affected site in these patients. This work summarizes current data regarding epidemiology, diagnosis and treatment recommendations. The review article is followed by a case report regarding the rare manifestation of cutaneous mucormycosis in an acute myeloid leukaemia patient. The aim of this work is to provide current information regarding this group of opportunistic infections with an increasing clinical impact. Only early diagnosis and rapid initiation of complex therapy can lead to a favourable outcome and complete cure.
ÚVOD
Invazivní mykotické infekce (IMI) jsou významnou příčinou morbidity a mortality u hematoonkologicky nemocných. Mezi klinicky nejvýznamnější skupiny IMI patří invazivní kandidóza a aspergilóza. S narůstajícím počtem hematologických pacientů, novými léčebnými modalitami s imunosupresivním potenciálem, ale i v důsledku selekčního tlaku antimykotické profylaxe začínají nabývat na významu dosud vzácní původci mykotických infekcí – mukormykózy [1]. Skupina patogenů, dříve označovaná jako zygomykózy, je heterogenní skupinou IMI vyvolanou zástupci rodů Mucor, Rhizopus, Lichtheimia, Rhizomucor, Cunninghamella, Apophysomyces, Saksenaea a Syncephalastrum. V současnosti užívané pojmenování, mukormykózy, vychází ze skutečnosti, že agens způsobující infekce u člověka pochází nejčastěji z řádu Mucorales [2]. Mezi nejvýznamnější globální druhy způsobující infekce u lidí patří Mucor circinelloides, Rhizopus oryzae, Rhizomucor pusilus a Lichtheimia corymbifera [3–6]. Tab. 1 zobrazuje taxonomii medicínsky nejdůležitějších původců mukormykóz. Klinický význam mukormykóz jako oportunních infekcí u imunosuprimovaných nemocných spočívá v jejich agresivním, lokálně destruktivním způsobu růstu, komplikované terapii a vysoké míře mortality. Cílem práce je přehledně přinést aktuální poznatky o mukormykózach široké hematologické obci.
EPIDEMIOLOGIE
Zástupci řádu Mucorales se vyskytují celosvětově jako saprotrofní organizmy na rozkládajícím se biologickém materiálu a v půdě [2]. Jako původci infekcí se uplatňují hlavně ve skupině těžce imunokompromitovaných nemocných. I když se jedná o vzácná onemocnění, incidence má narůstající tendenci. Po invazivní aspergilóze (IA) představují mukormykózy druhou nejpočetnější skupinu IMI způsobených vláknitými houbami u nemocných s hematologickými malignitami či podstupujících alogenní transplantaci krvetvorných buněk (allogeneic hematopoietic stem cell transplantation – alloHSCT). V rozvojových zemích postihují mukormykózy hlavně nemocné s nekontrolovaným diabetes mellitus (DM) či po těžkých traumatech a popáleninách [7–10]. Vzhledem ke vzácnosti onemocnění a heterogenitě predisponujících faktorů bylo zatím publikováno jen málo populačních studií. Epidemiologické studie z Evropy uvádí incidenci řádově v jednotkách případů na milion obyvatel (0,43–1,2/1 000 000 obyvatel/rok) [11,12]. Významně vyšší incidence je pozorována mimo Evropu. Např. v Indii dosahoval počet nemocných až 140/1000 000 obyvatel a rok s častým postižením pacientů s DM [9]. V neselektovaných souborech nemocných s mukormykózou dominantně z evropských center, představují pacienti s hematologickými malignitami 53–62 % postižené populace [13–15]. Na rozdíl od invazivní kandidózy a aspergilózy, u kterých zavedení účinné antimykotické profylaxe vedlo v posledních letech ke snížení incidence, má výskyt mukormykóz narůstající tendenci [16,17]. Recentně publikovaná práce Weinbergerové et al., zabývající se epidemiologií invazivních mykóz v letech 2013–2017, potvrdila trend nárůstu incidence mukormykóz jako průlomových infekcí (breakthrough) v hematoonkologických centrech v České a Slovenské republice [18]. Skutečná incidence mukormykóz však může být vyšší, než je uváděno v literatuře, a to vzhledem k obtížné diagnostice, klesajícímu trendu indikace pitev i absenci systematické surveillance.
RIZIKOVÉ FAKTORY
Mukormykózy jsou považovány za oportunní infekce, v literatuře však byly popsány i případy postižení u pacientů bez jasných predisponujících stavů [4]. Nejvíce ohroženi jsou nemocní s prolongovanou hlubokou neutropenií, např. podstupující indukční léčbu pro akutní myeloidní leukemii (AML) a alloHSCT [2,6,13,18]. Za další rizikové faktory jsou považovány přetížení železem (růstový faktor pro IMI), dlouhodobě špatně kompenzovaný DM, zvláště komplikovaný ketoacidózou (zvýšené uvolnění železa z vazebních proteinů), rozsáhlá poranění kožního krytu (polytraumata, popáleniny) a malnutrice. Ohroženi jsou i nedonošení novorozenci s nízkou porodní hmotností [2,4,19]. Při antimykotické profylaxi vorikonazolem či posakonazolem byly častěji zachyceny průlomové IMI způsobené zejména mukormykózami [6,16,18].
KLINICKÝ OBRAZ
Tkáňové nekrózy v důsledku angioinvazivního růstu a trombotizace představují typické histopatologické nálezy podmiňující výsledný klinický obraz mukormykóz. Podle anatomického místa vstupu infekčního agens se rozlišuje 5 základních forem mukormykózy. K infekci nejčastěji dochází respiračním traktem, poraněným kožním krytem (vč. kontaminovaných operačních nástrojů) nebo ingescí spor [2]. Mukormykóza může probíhat jako tzv. rhino-orbito-cerebrální, plicní, kožní či gastrointestinální forma nebo diseminované onemocnění [19]. Výsledky první rozsáhlé retrospektivní studie Rodena et al. naznačují vliv základní diagnózy na formu mukormykózy. V analýze z let 1940–2003 byl DM identifikován jako nejčastější
222/337 (66 %) nemocných s DM, na rozdíl od pacientů s malignitou, kde dominovalo plicní postižení zjištěné u 92/154 (60 %) nemocných. Nemocní bez zjevné predisponující příčiny trpěli nejčastěji kožní formou mukormykózy, což souvisí s vysokou prevalencí traumat a popálenin u této skupiny pacientů [4]. Korelace mezi predisponujícím onemocněním a formou mukormykózy byly zaznamenány i dalšími autory [13,14,20].
Rhino-orbito-cerebrální forma
Je globálně nejčastější formou invazivní mukormykózy. V literatuře bývá ve srovnání s jinými predisponujícími stavy častěji popisována u nemocných s DM [4,5,13,20]. Agens se šíří z paranazálních sinů, kam se spory dostanou vdechnutím, a dále se mohou lokálně šířit per continuitatem přes orbity do centrálního nervového systému (CNS). Symptomy iniciálně připomínají rhinosinusitidu, zahrnují bolesti hlavy, zduření sliznic, černou sekreci z nosu, horečky a otok měkkých tkání obličeje. Při postižení očnice dominuje bolest, chemóza spojivky, oftalmoplegie (při infiltraci okohybných svalů nebo hlavových nervů), dále protruze bulbu či ztráta zraku. Propagace do CNS se pak může projevit jako porucha vědomí či výpadek funkce jednotlivých hlavových nervů [21]. Z hlediska prognózy je zásadní rozdělení nemocných podle rozsahu postižení na: sinusitidu (postižení omezené jen na paranazální dutiny), sino-orbitální formu (s postižením paranazálních dutin a orbity) a rhino-cerebrální formu s propagací postižení do CNS [4].
Plicní forma
Druhou nejčastější formou je plicní mukormykóza postihující nejčastěji nemocné s hematologickými malignitami [4,5,13,22]. Klinický obraz je nespecifický, zahrnuje kašel, dušnost, horečky a pleurálně vázané bolesti. Aroze cév se manifestuje hemoptýzou a může dojít k systémové diseminaci, ke které má tato forma onemocnění největší tendenci. Klinický obraz i nálezy při zobrazovacích vyšetřeních u plicní mukormykózy jsou podobné jako u IA, což může činit problémy při diferenciální diagnostice [22]. Výskyt hemoptýzy je popisován u 13–28 % nemocných s plicní formou mukormykózy. Zobrazovací vyšetření nejčastěji prokazují unilaterální postižení (62–75 %) s dominantním postižením horních plicních laloků (40–45 %) [23–25]. Chamilos et al. zaznamenali signifikantně častější současné postižení paranazálních dutin u nemocných s plicní formou mukormykózy ve srovnání s IA [25]. V souboru hematologických pacientů s IA byla přítomnost plicní manifestace infekce signifikantně častější ve srovnání s mukormykózou (97 vs. 73 %; p = 0,02). Postižení dvou a více lokalit bylo pak významně četnější u mukormykotické infekce [26].
Kožní forma
Je třetím nejčastějším klinickým projevem infekce. Místem vstupu agens je přímá inokulace po poranění kožního krytu. Nejčastějším místem výskytu kožní formy mukormykózy jsou horní a dolní končetiny, ale postižená může být prakticky jakákoli část těla [27]. Typickým nálezem je černá eschara, u nemocných s rozsáhlým kožním defektem byly popsány i okem viditelné hyfy [28]. Invazivním růstem se pak infekce může šířit z kůže a podkoží (lokalizovaná forma) přes fascie, svaly až do kostí (invazivní forma). Při postižení více lokalit bez přímé anatomické souvislosti se jedná o systémově diseminované onemocnění. K hematogennímu šíření dochází u 16–20 % případů primárně kožního postižení. Tzv. reverzní diseminace, kdy dochází k rozšíření onemocnění do kůže, je však vzácná (3 %) [4,27].
Gastro-intestinální forma
K jejímu vzniku dochází jen vzácně, a to ingescí spor z kontaminovaného jídla či nápojů. Postižena může být kterákoli část zažívacího traktu, nejčastěji však dochází k postižení žaludku, colon a ilea [29]. Příznaky jsou nespecifické – bolesti břicha, nauzea a zvracení. V literatuře je uváděná narůstající incidence případů postižení u nedonošených dětí, pacientů s nespecifickými střevními záněty či uživatelů přírodních léčivých přípravků [2,4,30].
Diseminované onemocnění
Generalizovaná forma je definovaná jako postižení dvou a více anatomicky nenavazujících lokalit. Může vzniknout jako komplikace kterékoli z výše uvedených forem, nejčastěji v ni však přechází plicní forma mukormykózy, zejména u imunokompromitovaných nemocných. Klinický obraz může být velmi různorodý, v závislosti na primárním fokusu infekce, rozsahu diseminace a celkovém stavu nemocného [2,4]. Tato forma postižení má velmi nepříznivou prognózu [13].
Mortalita
V závislosti na formě onemocnění, stavu nemocného a rozsahu léčebných intervencí se mortalita mukormykózy referovaná v literatuře pohybuje v širokém rozmezí. Zatímco kožní forma mukormykózy má mortalitu kolem 30 %, diseminované onemocnění je fatální až u 95 % pacientů [4,5,27,31]. Recentní studie ukazují na obecně nižší mortalitu ve srovnání s historickými kohortami, zejména v důsledku lepší diagnostiky a dostupnosti účinných antimykotik [4,20,32]. Celkové přežití ve 12 týdnech bylo v souboru hematologických nemocných významně nižší u mukormykózy ve srovnání s IA (49 vs. 81 %; p = 0,0001) [26].
DIAGNOSTIKA
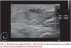
Správné určení původce IMI je zásadní pro výběr adekvátní léčebné strategie. Klinický obraz mukormykóz není patognomický pro tuto skupinu agens. Diagnostika je komplikovaná a často je potřebná biopsie z postižené tkáně k definitivnímu stanovení diagnózy. U imunokompromitovaných pacientů s plicním postižením je zásadní časné provedení bronchoalveolární laváže, která může poskytnout cenný materiál pro přímou mikroskopii, kultivační vyšetření či molekulárně genetickou detekci [33]. V histopatologickém nálezu jsou zjišťovány typické, téměř pravoúhle se větvící široké hyfy, které jsou ve stáří nepravidelně septované. Ischemie tkání, angioinvaze a perineurální šíření houbových vláken může přispět k odlišení od IA [34]. Protože jsou mukormycety poměrně běžnými laboratorními kontaminantami, je přímá optimálně fluorescenční mikroskopie z bronchoalveolární laváže, případně sputa, diagnosticky cennější než pozitivní kultivace. U nemocných s mukormykózou byl ve studii Klimko et al. signifikantně častější pozitivní kultivační záchyt z bronchoalveolární laváže ve srovnání s IA (65 vs. 17 %; p = 0,0001) [26]. Charakteristický růst mukormycet s pouhým okem viditelnými sporangii, jak je demonstrováno na obr. 1. a 2, může pomoci při orientační identifikaci. V indikovaných případech lze provést i testování citlivosti k antimykotikům. Identifikace původce onemocnění na úroveň druhu má však zatím spíše epidemiologický a výzkumný význam, neboť terapeutický přístup je pro celou skupinu původců stejný [34].
Sérologický průkaz antigenů (galaktomananu ani 1,3-beta-D-glukanu) nelze v laboratorní diagnostice využít, je však možno provést detekci houbové DNA molekulárně genetickými metodami, zejména polymerázovou řetězovou reakcí (polymerase chain reaction – PCR) [35]. Detekce cirkulující DNA mukormykóz s využitím kvantitativní PCR byla ve studii Millon et al. zjištěna v krvi o 9 (medián 0–28) dní dříve než mikrobiologický průkaz agens a o 2 (medián 0–24) dny dříve než nález při zobrazovacích vyšetřeních [36]. Použití PCR tak může pomoci při diagnostice u nemocných se suspektním klinickým obrazem, kdy výsledky kultivace či histopatologického vyšetření nejsou průkazné [37]. U rizikových pacientů s klinickým obrazem IMI, nálezem na zobrazovacích vyšetřovacích metodách a při negativitě výše uvedených sérologických markerů je vždy třeba myslet na mukormykózu. Podezření vyvolává i vznik onemocnění na antimykotické profylaxi vorikonazolem [14,16,18].
Radiologický obraz postižení plic při IA či mukormykóze není pro jednotlivé původce specifický. Podobně jako u IA jsou nejčastěji nacházeny konsolidace plicního parenchymu, noduly s okolními okrsky opacit mléčného skla či kavitace. Mezi vzácnější nálezy (méně než 10 % nemocných) patří mediastinální lymfadenopatie, air crescent sign (srpek plynu uvnitř plicního uzlu nebo konsolidace, který odpovídá probíhající kavitaci) nebo pneumotorax [23,24]. Reverzní halo-sign (reversed halo sign) – okrsek opacity mléčného skla, obklopený konsolidací plicního parenchymu na počítačové tomografii s vysokým rozlišením (high resolution computed tomography – HRCT), bývá v literatuře často spojovaný s mukormykózou. Další publikované práce však zaznamenaly podobný obraz i u jiných infekčních a neinfekčních onemocnění plic zahrnujících např. komunitní pneumonie, sarkoidózu či lymfomatoidní granulomatózu [25,26,38]. Chamilos et al. pozorovali signifikantně častěji záchyt více než 10 nodulů a pleurální efuze při CT vyšetření plic u nemocných s mukormykózou. Mikronoduly (< 1 cm) byly nevýznamně častěji pozorovány ve srovnání s plicní IA (55 vs. 18 %; p = 0,09), naopak makronoduly (> 3 cm) byly zachyceny jen u třetiny nemocných s plicní formou mukormykózy [25].
TERAPIE
Doporučení pro léčbu mukormykóz vychází z posledních ECIL-6 (European Conference on Infections in Leukaemia) guidelines z roku 2017 [39]. Pro terapii je zásadní multidisciplinární přístup kombinující antimykotickou léčbu, chirurgickou sanaci a kompenzaci predisponujícího onemocnění. Vzhledem ke vzácnosti onemocnění, heterogenitě postižené populace i klinické manifestace onemocnění doporučení pro léčbu vychází zejména z retrospektivních analýz publikovaných souborů nemocných.
Antimykotika
Mezi účinná antimykotika pro terapii mukormykóz patří amfotericin B, posakonazol a isavukonazol. V první linii léčby je doporučován lipozomální amfotericin B nebo jeho lipidový komplex (ve formě komplexu s fosfolipidy) v dávce 5–10 mg/kg denně, který ve studiích prokázal nejvyšší efektivitu při přijatelné toxicitě ve srovnání s jinými formami amfotericinu B. Lipozomální forma by měla být upřednostněna u nemocných s postižením CNS [34,39]. V případě selhání nebo intolerance léčby amfotericinem B je možné přistoupit k lékům druhé volby nebo kombinované terapii. Posakonazol je v první linii terapie indikován v případě absolutní kontraindikace amfotericinu B nebo při progresi onemocnění jako záchranná, tzv. salvage terapie [39]. Denní dávka 800 mg suspenze posakonazolu prokázala efektivitu, tj. dosažení kompletní nebo parciální remise, u 60 % nemocných ve druhé linii terapie invazivní mukormykózy [40]. Isavukonazol v denní dávce 200 mg (následující po standardní nasycovací dávce) měl ve studii Martyho et al. efektivitu srovnatelnou s amfotericinem B [41]. V ČR je isavukonazol indikován pro léčbu mukormykóz u nemocných s kontraindikací amfotericinu B [42]. V práci Pagana et al. vedla kombinace amfotericinu B s posakonazolem k terapeutické odpovědi (kompletní nebo parciální remise) u 18/32 (56 %) nemocných [43]. U pacientů s rhino-orbito-cerebrálním postižením byla zaznamenána 100% terapeutická odpověď při kombinaci amfotericinu B s kaspofunginem [44]. Tab. 2 přehledně zobrazuje dávkování antimykotik účinných u mukormykóz, dostupných v ČR.
Chirurgická sanace
Debridement postižených tkání představuje jeden ze základních pilířů terapie mukormykóz. Práce Teddera et al. prokázala významný pokles mortality u nemocných podstupujících chirurgickou sanaci plicního postižení ve srovnání s čistě medikamentózní léčbou (11 vs. 68 %; p = 0,0004) [31]. Chirurgická intervence je zcela zásadní u rhino-orbito-cerebrální formy s vysokým rizikem lokální invaze do CNS. Benefit chirurgické sanace infekčního fokusu prokázaly i další studie [13,15]. Naopak nemocní léčení jen chirurgicky (bez antimykotik) měli v rozsáhlé práci Rodena et al. nižší celkové přežití ve srovnání s nemocnými podstupujícími kombinovanou terapii (59 vs. 70 %) [4]. Kombinace chirurgické terapie a systémové antimykotické terapie vedla k signifikantnímu poklesu mortality při srovnání s pouhou farmakoterapií. Pokud je to možné, měly by být obě léčebné modality použity současně [4,5,13–15].
Kompenzace predisponující příčiny
Spolu s terapií mukormykózy je vždy nutné současně eliminovat vliv rizikových faktorů podílejících se na vzniku infekce. Tyto postupy zahrnují terapii neutropenie u nemocných v agranulocytóze (granulocytární kolonie stimulující faktor – G-CSF, případně granulocytární koncentráty), kompenzace DM a ketoacidózy. Ferochelatační léčba je vhodná u pacientů přetížených železem. Kortikosteroidní a jiná imunosupresivní léčba by měla být u nemocných podávaná jen v nejnutnějších případech a v nejnižší možné účinné dávce [34]. Dalším, zatím spíše experimentálním přístupem, je použití hyperbarické komory [39].
Profylaxe
Posakonazol (suspenze v denní dávce 600 mg) prokázal efektivitu v primární antimykotické profylaxi u nemocných s vysokým rizikem IMI, tj. u pacientů podstupujících indukční léčbu pro AML, myelodysplastický syndrom nebo s reakcí štěpu proti hostiteli (graft versus host disease – GVHD). Průlomové IMI (vč. mukormykóz) při profylaxi posakonazolem jsou referovány ve studiích jen vzácně (2,0–2,4 %) [45–47]. Retrospektivní analýza Oha et al. prokázala významný rozdíl v efektivní plazmatické koncentraci ve skupině pacientů dostávajících posakonazol v tabletách ve srovnání se suspenzí (89,0 vs. 46,6 %; p < 0,001). Incidence průlomových IMI byla signifikantně vyšší při profylaxi suspenzí (14,8 vs. 4,5 %; p = 0,005) [48]. U vysoce rizikových pacientů s vyléčenou mukormykózou je vhodné zvážit udržovací léčbu, případně sekundární profylaxi posakonazolem [14,34]. Posakonazol je jediným dostupným antimykotikem indikovaným v profylaxi IMI s účinností u mukormykóz v ČR [49].
KAZUISTIKA – KOŽNÍ FORMA MUKORMYKÓZY
Prezentujeme případ 63letého nemocného referovaného na naše pracoviště praktickým lékařem v lednu 2016 k došetření trombocytopenie s krvácivými komplikacemi. Na základě vyšetření krevního obrazu a kostní dřeně s nálezem 7 % myeloblastů byla diagnóza uzavřena jako chronické myeloproliferativní onemocnění blíže neurčené. Nemocný byl kromě hypertenzní nemoci jinak zdravý a aktivně pracující na svojí farmě, kde choval králíky, koně a drůbež.
Pacient byl ambulantně sledován až do června 2016, kdy došlo k progresi onemocnění do AML. Od 12. 7. 2016 byl po cytoredukci hydroxyureou podán 1. cyklus indukční léčby ve složení 5 + 3 (daunorubicin 60 mg/m2, den 1–3 a cytosin-arabinosid 100 mg/m2, den 1–5). Cyklus byl předčasně ukončen pro flegmónu v místě zavedení centrální žilní kanyly. Pro perzistenci onemocnění i závažné komplikace indukční léčby byl nemocný indikován k další substituční a cytoredukční terapii nízce dávkovaným cytosin-arabinosidem (low-dose cytarabine – LDAC). Poslední (celkem 2. cyklus LDAC) byl podán od 8. 12. 2016. Antimykotická profylaxe flukonazolem v denní dávce 200 mg byla nemocnému podávána až od poloviny ledna 2017.
V únoru 2017 byl nemocný hospitalizován na naší klinice pro septický stav se záchytem Enterobacter ludwigi v hemokultuře. Po vytržení periferní kanyly pacientem byla komplikací flegmóna na levém předloktí s následným rozvojem nekrotického ložiska. Ultrazvukové vyšetření prokázalo tekutinovou kolekci (v.s. absces) velikosti 22 × 33 × 5 mm. Obr. 3 a 4 ukazují rozsah postižení na volární a dorzální straně předloktí. Obr. 5 zobrazuje tekutinovou kolekci v ráně při ultrazvukovém vyšetření. Chirurgem byla indikována konzervativní terapie bez možnosti punkce pro povrchově probíhající žílu a refrakterní trombocytopenii. Provedená mikrobiologická vyšetření nenalezla v ráně žádné infekční agens. Zahájena byla proto empirická antiinfekční terapie s postupnou eskalací na kombinaci meropenemu, vankomycinu, metronidazolu a mikafunginu. Na této terapii dochází ke stabilizaci a následně i mírnému zlepšení lokálního nálezu s mumifikací nekrózy a regresí okolního otoku s laboratorním poklesem CRP. Bakteriologická kultivační vyšetření byla opakovaně negativní a teprve z mykologické kultivace byla hlášena vláknitá houba Mucor sp. U pacienta s refrakterní trombocytopenií a neutropenií bez perspektivy restituce krevního obrazu při paliativně léčené AML nebylo chirurgické řešení, debridement, proveditelné a byla indikována jen systémová antimykotická terapie. Vzhledem k celkovému stavu pacienta, prognóze základního onemocnění a preferenci ambulantní léčby byla zvolena perorální terapie posakonazolem v denní dávce 300 mg (3× 100 mg tablety). Na zavedené terapii byl klinický nález na ruce stabilní, bez zjevné lokální progrese. V dalším průběhu však dochází k postupné progresi hematologického onemocnění s nutností pravidelné hemosubstituce a cytoredukce vysokými dávkami hydroxyurey. Pacient dne 25. 5. 2017 zemřel ve spádové nemocnici pod obrazem náhlé příhody břišní (v.s. krvácení do gastrointestinálního traktu). Celková doba, po kterou byl nemocný léčen ambulantně bez zjevné klinické progrese kožní formy mukormykózy, byla 3 měsíce. Nemocný nakonec podlehl pravděpodobně neinfekčním komplikacím základního maligního onemocnění.
DISKUZE
Mukormykózy jsou skupinou IMI u nemocných s hematologickou malignitou s narůstajícím klinickým významem. Případy kožní formy mukormykózy jsou u této skupiny nemocných vzácné ve srovnání s plicní formou, která je nejčastějším typem postižení. V práci Rodena et al. bylo ve skupině 154 nemocných s malignitou, z toho 147 (95 %) tvořili nemocní s hematologickým onemocněním, zachyceno také postižení kůže a podkoží u 12 % a plicní forma u 60 % pacientů [4]. Podobně Weinbergerová et al. v souboru hematologických nemocných se vzácnou invazivní mykózou (dominantně mukormykózou) nejčastěji zaznamenala plicní a diseminovanou formu onemocnění (83–98 %), jiné formy postižení představovaly jen 2–17 % [18]. I když je referován trend nárůstu incidence mukormykóz u hematologických nemocných, IA je v souborech pořád popisována 5–9× častěji [16,18,26]. Zásadní pro zjištění skutečné incidence mukormykózy v populaci i v selektovaných skupinách nemocných je systematická surveillance. V případě hematologických pacientů v našem regionu tuto nezastupitelnou úlohu plní FIND – Databáze případů invazivních mykotických infekcí u hematooonkologických nemocných v České a Slovenské republice [18].
Mezi nejvýznamnější rizikové faktory pro rozvoj mukormykózy patří neutropenie a porušení mukokutánních bariér. Příčinou častějšího plicního postižení u nemocných s malignitou může být chemoterapií indukovaná mukociliární dysfunkce [4]. U našeho nemocného bylo současně přítomno několik rizikových faktorů – progredující hematologická malignita, velmi suspektní kolonizace (opakovaná expozice ubikvitním vláknitým houbám) v důsledku péče o hospodářská zvířata i absence efektivní antimykotické profylaxe. Kožní forma mukormykózy je však popisována i u nemocných bez zjevného imunodeficitu. V souboru 78 nemocných s kožním postižením bylo až 31 (40 %) imunokompetentních [27]. Roden et al. ve skupině 176 nemocných s kožním postižením zaznamenali až 50 % pacientů bez imunodeficitu [4]. V literatuře byly popsány i případy mukormykóz ve formě nozokomiálních infekcí [10,50].
Základem diagnostiky mukormykóz zůstává histopatologická verifikace a/nebo kultivační průkaz agens, často vyžadující invazivní techniky k získání klinického materiálu. Určení původce infekce na úroveň druhu není nezbytně nutné k zahájení adekvátní terapie, má ale význam v epidemiologickém výzkumu. Např. Lanternier et al. popsali signifikantně častější záchyt R. oryzae u rhinocerebrální formy ve srovnání s non-rhinocerebrální formou postižení (87 vs. 13 %; p < 0,001) [13]. U našeho nemocného nebylo agens určeno na úroveň druhu. Vzhledem k obtížnosti až nemožnosti spolehlivé druhové identifikace agens klasickými morfologickými metodami uvádí i řada publikovaných prací poměrně vysoký podíl blíže neurčených původců mukormykózy (8–29 %) [5,14,15]. Perspektivou pro epidemiologické studie je v tomto směru určování hub pomocí hmotnostní spektrometrie (MALDI-TOF) a molekulárně genetických metod. Další možností využití kvantitativní PCR, kromě non-invazivní diagnostiky ze séra, je i monitorování efektu terapie. Skupina nemocných, která dosáhla negativity PCR po zahájení terapie, měla ve 12 týdnech od stanovení diagnózy významně lepší celkové přežití ve srovnání s nemocnými s přetrvávající pozitivitou PCR (48 vs. 4 %; p < 10–6) [36].
Diferenciální diagnostika postižení při mukormykóze je často značně komplikovaná. Vždy je třeba zvažovat kromě neinfekční příčiny v diferenciální diagnostice i bakteriální superinfekci nebo současnou přítomnost dvou mykotických agens. Chrenková et al. popsali v souboru 8 dětských pacientů s mukormykózou ve dvou případech souběh s aspergilózou a v jednom případě s kandidózou [51]. V souboru 35 nemocných s plicní formou mukormykózy zaznamenali Lin et al. bakteriémii u 7 (20 %) pacientů. Její výskyt byl významně asociovaný s vyšší mortalitou [22,26]. Souběh bakteriémie a mukormykózy byl zachycen i u nemocného v kazuistice. Antimykotická profylaxe, zejména azoly neúčinnými u mukormykóz (flukonazol, itrakonazol a vorikonazol) nebo posakonazolem se subterapeutickými hladinami, může dávat falešný „pocit jistoty“, a diagnostika IMI tak může být zpožděna [14,48]. Komplikovanost diagnostiky mukormykóz dokládají i výsledky studií, v nichž až 6–13 % nemocných nepodstoupilo systémovou léčbu v důsledku pozdní identifikace mykózy (krátce ante mortem či až post mortem) [5,13–15].
Zavedení amfotericin B deoxycholátu do terapie IMI v 60. letech vedlo ke snížení mortality mukormykóz z 84 % v 50. letech na 47 % v 90. letech 20. století [4]. Případy, kdy je onemocnění vyléčeno jen důkladnou chirurgickou sanací fokusu, byly popsány u nemocných bez imunodeficitu s lokalizovaným postižením – kožní infekce, mycetom [5,14,15]. Nutnost současného provedení chirurgické sanace fokusu byla signifikantně vyšší u nemocných s mukormykózou ve srovnání s IA [26].
U našeho nemocného nebyl chirurgický výkon pro těžkou refrakterní trombocytopenii a nepříznivé lokální anatomické poměry proveditelný. I když nejlepší výsledky terapie byly popsány u systémového podávání amfotericinu B, u pacienta v paliativní, substituční a cytoredukční léčbě s primárně refrakterní AML byl zvolen posakonazol, pro možnost ambulantní léčby se zachováním lepší kvality života nemocného.
Navzdory pokrokům v diagnostice a terapii zůstává mortalita mukormykózy stále vysoká. Významně vyšší mortalita byla pozorována ve skupině nemocných s hematologickou malignitou ve srovnání s DM nebo traumatem (60 vs. 32 vs. 11 %; p = 0,008) [13]. V práci Skiady et al. byly úrazy jako predisponující faktory spolu s chirurgickým přístupem a léčbou amfotericinem B v souboru 230 nemocných sdruženy se signifikantně lepší prognózou [5]. Výsledky se zdají být logické – nemocní s hematologickou malignitou jsou při dlouhodobé neutropenii či v důsledku imunosupresivní léčby (např. reakce štěpu proti hostiteli) více ohroženi i dalšími oportunními infekcemi a mortalitou na základní diagnózu [14,26,36]. Analogicky byla pozorována signifikantně vyšší mortalita u nemocných s dvěma predisponujícími nemocemi/stavy ve srovnání s pacienty < 2 rizikovými faktory [13].
Pacient v naší kazuistice byl pro kožní mukormykózu léčen přibližně tři měsíce, kdy jeho stav nevyžadoval hospitalizaci a byl schopen ambulantní léčby. Kazuistika ukazuje individuální terapeutický přístup k nemocnému s nevyléčitelným základním hematologickým onemocněním, závažnou infekční komplikací a podle našeho názoru optimálně vedenou léčbou se zaměřením na kvalitu života nemocného.
ZÁVĚR
V důsledku stoupající incidence nádorových onemocnění, epidemii obezity a DM, indikaci kortikosteroidů u zánětlivých onemocnění či počtu transplantací solidních orgánů a krvetvorných buněk se dá předpokládat nárůst počtu případů mukormykóz. Je nezbytný další výzkum k urychlení diagnostiky a ke zvýšení účinnosti terapie těchto devastujících infekcí. Nezanedbatelnou úlohu při studii vzácných IMI sehrávají i národní či mezinárodní registry. Jen ty umožňují zjistit reálná populační data a provést retrospektivní analýzy. Předpokladem zlepšení výsledků léčby mukormykóz je indikovat včas příslušná vyšetření a neprodleně zahájit účinnou komplexní léčbu spolu s kompenzací predisponujících rizikových faktorů.
PODÍL AUTORŮ NA PŘÍPRAVĚ RUKOPISU
MČ – hlavní autor práce, léčba nemocného
TS – korespondující spoluautor, léčba nemocného
RM – léčba nemocného, kritická revize rukopisu
MP – léčba nemocného, kritická revize rukopisu
PH – laboratorní diagnostika, kritická revize rukopisu
EF – kritická revize rukopisu
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů, a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Tohle prohlášení se vztahuje i na spoluautory RM, MP, PH. Spoluautor TS deklaruje konzultační činnost pro společnosti Pfizer, Novartis a Merck Sharp & Dohme. Spoluautor EF deklaruje konzultační činnost pro Angelini, Bristol-Myers Squibb, Novartis a podporu účasti na konferencích od Angelini, Bristol-Myers Squibb, Novartis, Pfizer a TERUMO.
DEDIKACE GRANTU
Práce byla podpořena grantem IGA_LF_2020_ 002 a MZ ČR – RVO (FNOL, 00098892).
Doručeno do redakce dne 3. 3. 2020.
Přijato po recenzi dne 9. 10. 2020.
doc. MUDr. Tomáš Szotkowski, Ph.D.
Hemato-onkologická klinika
LF UP a FN Olomouc
I.P. Pavlova 6
77 900 Olomouc
e-mail: tomas.szotkowski@fnol.cz
Literatura
1. Pagano L, Busca A, Candoni A, et al. Risk stratification for invasive fungal infections in patients with hematological malignancies: SEIFEM recommendations. Blood Rev. 2017; 31(2): 17–29.
2. Binder U, Maurer E, Lass-Flörl C. Mucormycosis – from pathogen to the disease. Clin Microbiol Infect. 2014; Suppl 6: 60–66.
3. Prakash H, Chakrabarti A. Global epidemiology of mucormycosis. J Fungi (Basel). 2019; 5 (1): 26.
4. Roden MM, Zaoutis TE, Buchanan WL, et al. Epidemiology and outcome of zygomycosis: a review of 929 reported cases. Clin Infect Dis. 2005; 41 (5): 634–653.
5. Skiada A, Pagano L, Groll A, et al. Zygomycosis in Europe: analysis of 230 cases accrued by the registry of the European Confederation of Medical Mycology (ECMM) Working Group on Zygomycosis between 2005 and 2007. Clin Microbiol Infect. 2011; 17 (12): 1859–1867.
6. Kontoyiannis DP, Lionakis MS, Lewis RE, et al. Zygomycosis in a tertiary-care cancer center in the era of Aspergillus-active antifungal therapy: a case-control observational study of 27 recent cases. J Infect Dis. 2005; 191 (8): 1350–1360.
7. Petrikkos D, Skiada A, Lortholary O, Roilides E, Walsh TJ, Kontoyiannis DP. Epidemiology and clinical manifestations of mucormycosis. Clin Infect Dis. 2012; 54: 23–34.
8. Skiada A, Lass-Floerl C, Klimko N, Ibrahim A, Roilides E, Petrikkos G. Challenges in the diagnosis and treatment of mucormycosis. Med Mycol. 2018; 56 (suppl 1): 93–101.
9. Chakrabarti A. Mucormycosis in Asia. In: Chakrabarti A. (eds) Clinical practice of medical mycology in Asia. Singapore, Springer, 2017, 279–292.
10. Chakrabarti A, Chatterjee SS, Das A, et al. Invasive zygomycosis in India: experience in a tertiary care hospital. Postgrad Med J. 2009; 85 (1009): 573–581.
11. Bitar D, Cauteren DV, Lanternier F, et al. Increasing incidence of zygomycosis (mucormycosis), France, 1997–2006. Emerg Infect Dis. 2009; 15 (9): 1395–1401.
12. Torres-Narbona M, Guinea J, Martines-Alarcón J, Muñoz P, Gadea I, Bouza E. Impact of zygomycosis on microbiology workload: a survey study in Spain. J Clin Microbiol. 2007; 45 (6): 2051–2053.
13. Lanternier F, Dannaoui E, Morizot G, et al. A global analysis of mucormycosis in France: The RetroZygo Study (2005–2007). Clin Infect Dis 2012; 54 (Suppl 1): 35–43.
14. Rüping MJ, Heinz WJ, Kindo AJ, et al. Forty-one recent cases of invasive zygomycosis from a global clinical registry. J Antimicrob Chemother. 2010; 65 (2): 296–302.
15. Pana ZD, Seidel D, Skiada A, et al. Invasive mucormycosis in children: an epidemiologic study in European and non-European countries based on two registries. BMC Infect Dis. 2016; 16 (1): 667.
16. Lewis RE, Cahyame-Zuniga L, Leventakos K, et al. Epidemiology and sites of involvement of invasive fungal infections in patients with haematological malignancies: a 20-year autopsy study. Mycoses. 2013; 56 (6): 638–645.
17. Charlier C, Hart E, Lefort A, et al. Fluconazole for the management of invasive candidiasis: where do we stand after 15 years? J Antimicrob Chemother. 2006; 57 (3): 384–410.
18. Weinbergerová B, Kabut T, Kocmanová I, et al. Změny v epidemiologii invazivních mykotických infekcí v českých a slovenských hematoonkologických centrech v letech 2005–2017: analýza dat FIND. Transfuze Hematol Dnes. 2019; 25 (2): 186–196.
19. Sun HY, Singh N. Mucormycosis: its contemporary face and management strategies. Lancet Infect Dis. 2011; 11 (4): 301–311.
20. Jeong W, Keighley C, Wolfe R, et al. The epidemiology and clinical manifestations of mucormycosis: a systematic review and meta-analysis of case reports. Clin Microbiol Infect. 2019; 25 (1): 26–34.
21. Teixeira CA, Bettencourt Medeiros P, Leushner P, Almeida F. Rhinocerebral mucormycosis: literature review apropos of a rare entity. BMJ Case Rep. 2013; 2013: bcr2012008552.
22. Lin E, Moua T, Limper AH. Pulmonary mucormycosis: clinical features and outcomes. Infection. 2017; 45 (4): 443–448.
23. Lee FYW, Mossad SB, Adal KA. Pulmonary mucormycosis: the last 30 years. Arch Intern Med. 1999; 159 (12): 1301–1309.
24. Feng J, Sun X. Characteristics of pulmonary mucormycosis and predictive risk factors for the outcome. Infection. 2018; 46 (4): 503–512.
25. Chamilos G, Marom EM, Lewis RE, Lionakis MS, Kontoyiannis DP. Predictors of pulmonary zygomycosis versus invasive pulmonary aspergillosis in patients with cancer. Clin Infect Dis. 2005; 41 (1): 60–66.
26. Klimko N, Khostelidi S, Shadrivova O, et al. Contrasts between mucormycosis and aspergillosis in oncohematological patients. Medical Mycology. 2019; 57 (Suppl 2): 138–144.
27. Skiada A, Petrikkos G. Cutaneous mucormycosis. Skinmed. 2013; 11 (3): 155–159.
28. Chawla R, Sehgal S, Kumar S R, Mishra B. A rare case of mucormycosis of median sternotomy wound caused by Rhizopus arrhizus. Indian J Med Microbiol. 2007; 25: 419–421.
29. Spellberg B. Gastrointestinal mucormycosis. Gastroenterol Hepatol (N Y). 2012; 8 (2): 140–142.
30. Morton J, Nguyen V, Ali T. Mucormycosis of the intestine. A rare complication in Crohn‘s disease. Gastroenterol Hepatol (N Y). 2012; 8 (2): 137–140.
31. Tedder M, Spratt JA, Anstadt MP, Hegde SS, Tedder SD, Lowe JE. Pulmonary mucormycosis: results of medical and surgical therapy. Ann Thorac Surg. 1994; 57 (4): 1044–1050.
32. Hammond SP, Baden LR, Marty FM. Mortality in hematologic malignancy and hematopoietic stem cell transplant patients with mucormycosis, 2001 to 2009. Antimicrob Agents Chemother. 2011; 55 (11): 5018–5021.
33. Knox KS, Meinke L. Role of bronchoalveolar lavage diagnostics in fungal infections. Clin Chest Med. 2009; 30 (2): 355–365.
34. Cornely OA, Arikan-Akdagli S, Dannaoui E, et al. ESCMID and ECMM joint clinical guidelines for the diagnosis and management of mucormycosis 2013. Clin Microbiol Infect. 2014; Suppl 3: 5–26.
35. Skiada A, Lanternier F, Groll AH, et al. Diagnosis and treatment of mucormycosis in patients with hematological malignancies: guidelines from the 3rd European Conference on Infections in Leukemia (ECIL 3). Haematologica. 2013; 98 (4): 492–504.
36. Millon L, Herbrecht R, F Grenouillet, et al. Early diagnosis and monitoring of mucormycosis by detection of circulating DNA in serum: retrospective analysis of 44 cases collected through the French Surveillance Network of Invasive Fungal Infections (RESSIF). Clin Microbiol Infect. 2016; 22 (9); 810.e1–810.e8.
37. Mercier T, Reynders M, Beuselinck K, et al. Serial detection of circulating mucorales DNA in invasive mucormycosis: a retrospective multicenter evaluation. J Fungi (Basel). 2019; 5 (4): 113.
38. Godoy MC, Viswanathan C, Marchiori E, et al. The reversed halo sign: update and differential diagnosis. Br J Radiol. 2012; 85 (1017): 1226–1235.
39. Tissot F, Agrawal S, Pagano L, et al. ECIL-6 Guidelines for the treatment of invasive candidiasis, aspergillosis and mucormycosis in leukemia and hematopoietic stem cell transplant patients. Haematologica. 2017; 102 (3): 433–444.
40. van Burik JA, Hare RS, Solomon HF, Corrado ML, Kontoyiannis DP. Posaconazole is effective as salvage therapy in zygomycosis: a retrospective summary of 91 cases. Clin Infect Dis. 2006; 42 (7): e61–e65.
41. Marty FM, Ostrosky-Zeichner L, Cornely A, et al. Isavuconazole treatment for mucormycosis: a single-arm open-label trial and case-control analysis. Lancet Infect Dis. 2016; 16 (7): 828–837.
42. SÚKL: Cresemba 100mg cps. Souhrn údajů o přípravku. [online]. 2020 [cit. 2020-03-03]. Dostupné z: https: //www.sukl.cz/.
43. Pagano L, Cornely OA, Busca A, et al. Combined antifungal approach for the treatment of invasive mucormycosis in patients with hematologic diseases: a report from the SEIFEM and FUNGISCOPE registries. Haematologica. 2013; 98 (10): e127–e130.
44. Reed C, Bryant R, Ibrahim AS, et al. Combination polyene-caspofungin treatment of rhino-orbital-cerebral mucormycosis. Clin Infect Dis. 2008; 47 (3): 364–371.
45. Ullmann AJ, Lipton JH, Vesole DH, et al. Posaconazole or fluconazole for prophylaxis in severe graft-versus-host disease. N Engl J Med. 2007; 356 (4): 335–347.
46. Cornely OA, Maertens J, Winston DJ, et al. Posaconazole vs. fluconazole or itraconazole prophylaxis in patients with neutropenia. N Engl J Med. 2007; 356 (4): 348–359.
47. Lekakis LJ, Lawson A, Prante J, et al. Fatal rhizopus pneumonia in allogeneic stem cell transplant patients despite posaconazole prophylaxis: two cases and review of the literature. Biol Blood Marrow Transplant. 2009; 15 (8): 991–995.
48. Oh J, Kang CI, Kim SH, et al. Antifungal prophylaxis with posaconazole tablet and oral suspension in patients with haematologic malignancy: Therapeutic drug monitoring, efficacy and risk factors for the suboptimal level. Mycoses. 2020; 63 (1): 89–94.
49. SÚKL: Noxafil 40mg/ml perorální suspenze. Souhrn údajů o přípravku. [online]. 2020 [cit. 2020-03-03]. Dostupné z: https: //www.sukl.cz/.
50. Christiaens G, Hayette MP, Jacquemin D, Melin P, Mutsers J, De Mol P. An outbreak of Absidia corymbifera infection associated with bandage contamination in a burns unit. J Hosp Infect. 2005; 61 (1): 88.
51. Chrenková V, Hubáček P, Weinbergerová B, et al. Invazivní mukormykóza u dětských hematoonkologických pacientů: zkušenosti 2005-2010. Klin Mikrobiol Infek Lek. 2012; 18 (4): 102–108.
52. Státní ústav pro kontrolu léčiv. [online]. 2020 [cit. 2020-03-03]. Dostupné z: https: //www.sukl.cz/.
Článek byl uveřejněn s laskavým svolením redakce Transfuze a hematologie dnes.
www.prolekare.cz/casopisy/transfuze-hematologie-dnes